三 電化學(xué)類儲能
電化學(xué)類儲能主要包括各種二次電池,有鉛酸電池、鋰離子電池、鈉硫電池和液流電池等,這些電池多數(shù)技術(shù)上比較成熟,近年來成為關(guān)注的重點,并且還獲得許多實際應(yīng)用。
3.1 鉛酸電池
(1)基本原理
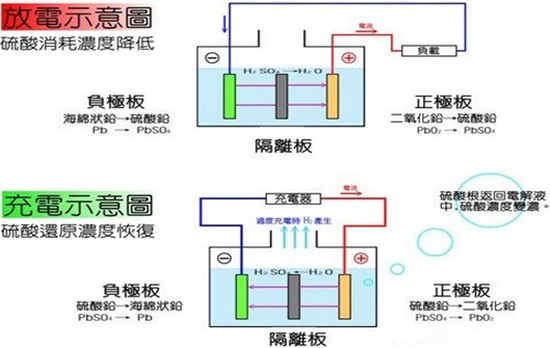
鉛酸電池是世界上應(yīng)用最廣泛的電池之一。鉛酸電池內(nèi)的陽極(PbO2)及陰極(Pb)浸到電解液(稀硫酸)中,兩極間會產(chǎn)生2V的電勢,這就是鉛酸電池的原理。經(jīng)由充放電,則陰陽極及電解液即會發(fā)生如下的變化:
(陽極) (電解液) (陰極)
PbO2 + 2H2SO4 + Pb ---> PbSO4 + 2H2O + PbSO4 (放電反應(yīng))
(過氧化鉛) (硫酸) (海綿狀鉛)
(陽極) (電解液) (陰極)
PbSO4 + 2H2O + PbSO4---> PbO2+ 2H2SO4+ Pb (充電反應(yīng))
(硫酸鉛) (水) (硫酸鉛)
(2)優(yōu)點
技術(shù)很成熟,結(jié)構(gòu)簡單、價格低廉、維護(hù)方便;
循環(huán)壽命可達(dá)1000次左右;
效率可達(dá)80%至90%,性價比高。
(3)缺點
深度、快速、大功率放電時,可用容量下降;
能量密度較低,壽命較短。
(4)應(yīng)用
鉛酸電池常常用于電力系統(tǒng)的事故電源或備用電源,以往大多數(shù)獨立型光伏發(fā)電系統(tǒng)配備此類電池。目前有逐漸被其他電池(如鋰離子電池)替代的趨勢。
3.2 鋰離子電池
(1)基本原理
鋰離子電池實際上是一個鋰離子濃差電池,正負(fù)電極由兩種不同的鋰離子嵌入化合物構(gòu)。充電時,Li+從正極脫嵌經(jīng)過電解質(zhì)嵌入負(fù)極,此時負(fù)極處于富鋰態(tài),正極處于貧鋰態(tài);放電時則相反,Li+從負(fù)極脫嵌,經(jīng)過電解質(zhì)嵌入正極,正極處于富鋰態(tài),負(fù)極處于貧鋰態(tài)。

(2)優(yōu)點
鋰離子電池的效率可達(dá)95%以上;
放電時間可達(dá)數(shù)小時;
循環(huán)次數(shù)可達(dá)5000次或更多,響應(yīng)快速;
鋰離子電池是電池中比能量最高的實用型電池,有多種材料可用于它的正極和負(fù)極(鈷酸鋰鋰離子電池、錳酸鋰鋰離子電池、磷酸鐵鋰鋰離子電池、鈦酸鋰鋰離子電池等)。
(3)缺點
鋰離子電池的價格依然偏高;
有時會因過充電而導(dǎo)致發(fā)熱、燃燒等安全問題,有一定的風(fēng)險,所以需要通過過充電保護(hù)來解決。
(4)應(yīng)用
由于鋰離子電池在電動汽車、計算機、手機等便攜式和移動設(shè)備上的應(yīng)用,所以它目前幾乎已成為世界上應(yīng)用最為廣泛的電池。鋰離子電池的能量密度和功率密度都較高,這是它能得到廣泛應(yīng)用和關(guān)注的主要原因。它的技術(shù)發(fā)展很快,近年來,大規(guī)模生產(chǎn)和多場合應(yīng)用使其價格急速下降,因而在電力系統(tǒng)中的應(yīng)用也越來越多。鋰離子電池技術(shù)仍然在不斷地開發(fā)中,目前的研究集中在進(jìn)一步提高它的使用壽命和安全性,降低成本、以及新的正、負(fù)極材料的開發(fā)上。
3.3 鈉硫電池
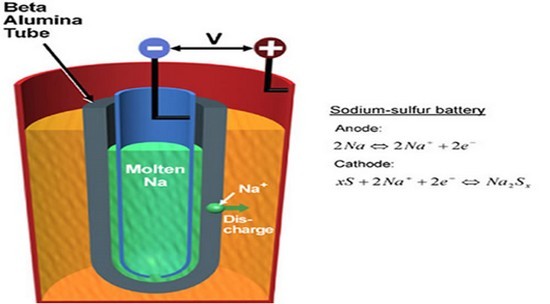
(1)基本原理
鈉硫電池的陽極由液態(tài)的硫組成,陰極由液態(tài)的鈉組成,中間隔有陶瓷材料的貝塔鋁管。電池的運行溫度需保持在300℃以上,以使電極處于熔融狀態(tài)。
(2)優(yōu)點
循環(huán)周期可達(dá)4500次;
放電時間可達(dá)6至7小時;
周期往返效率約為75%;
它的能量密度高,響應(yīng)時間快(毫秒級)。
(3)缺點
由于它使用了金屬鈉,是一種易燃物,又運行在高溫下,所以存在一定的風(fēng)險。
(4)應(yīng)用
日本的NGK公司是世界上唯一能制造出高性能的鈉硫電池的廠家。目前采用50kW的模塊,可由多個50kW的模塊組成MW級的大容量的電池組件。在日本、德國、法國、美國等地已建有約200多處此類儲能電站,主要用于負(fù)荷調(diào)平、移峰、改善電能質(zhì)量和可再生能源發(fā)電,電池價格仍然較高。


